- Gerar link
- X
- Outros aplicativos
TEORIA UNIFICADORA TENSORIAL G+ GRACELI
TEORIA TENSORIAL G+ GRACELI , VISA UNIFICAR TODA A FÍSICA ATRAVÉS DO TENSOR G+ PARA CAMPOS [GRAVIDADE, ELETROMAGNETISMO, FORTE E FRACO] ONDE O ESSENCIAL É O TENSOR G+ DE CAMPOS E MOVIMENTOS, ENERGIA E ESTRUTURAS.
E UNIFICAR TAMBÉM A QUÂNTICA COM AS RELATIVIDADES.
ENQUANTO NO SISTEMA SDCTIE GRACELI, O QUE SE TEM UM SISTEMA DE MAIS DE DUZENTAS DIMENSÕES COM SUAS VARIAÇÕES, E CATEGORIAS, ESTADOS FÍSICOS, QUÍMICO, FENOMÊNICOS E TRANSIÇÕES DE ESTRUTURAS, INTERAÇÕES E TRANSFORMAÇÕES, FORMANDO UM SISTEMA COM CINCO PILARES.
ENERGIA = ONDAS = GEOMETRIA CURVA = GRAVIDADE E OUTROS CAMPOS = MOMENTUM = FENÔMENOS = INTERAÇÕES = TRANSFORMAÇÕES = TEMPO = ESPAÇO
TEORIA GERAL DE GRACELI COM O TENSOR GRACELI = G + = TENSOR CURVATURA-ONDA-ENERGIA-CAMPOS GRACELI.
TEORIA GERAL DE GRACELI COM O TENSOR GRACELI = G +
ENERGIA = ONDAS = GEOMETRIA CURVA = GRAVIDADE E OUTROS CAMPOS = MOMENTUM = FENÔMENOS = INTERAÇÕES = TRANSFORMAÇÕES = TEMPO = ESPAÇO
G + = GRAVIDADE E TENSOR CURVATURA-ONDA GRACELI. = RELAÇÃO DE CONTINUUM E UNICIDADE ENTRE ENERGIA, ONDAS, GEOMETRIA, E CAMPOS. = G + É MAIS ABRANGENTE E FORMA UMA UNICIDADE ENTRE A QUÂNTICA, RELATIVIDADES [GERAL E RESTRITA] GEOMETRIA, E TEORIA DE CAMPOS, ELETROQUÂNTICA, CORDAS, TEORIA M, E ELETROMAGNETISMO, E OUTRAS.
TENSOR CURVATURA-ONDA-ENERGIA-CAMPOS GRACELI. [CAMPOS: GRAVIDADE, ELETROMAGNETISMO, FORTE E FRACO].
RELAÇÃO DE CONTINUUM E UNICIDADE ENTRE ENERGIA, ONDAS, GEOMETRIA, E CAMPOS. = G +
CURVATURA-ONDA GRACELI NA GRAVIDADE, CAMPOS [ELETROMAGNÉTICO, FORTE FRACO, E NA QUÃNTICA].
CURVATURA-ONDA GRACELI.
CURVATURA-ONDA GRACELI.
SISTEMA FÍSICO GEOMÉTRICO QUE VARIA EM RELAÇÃO AO TEMPO, DE DENTRO PARA FORA NUM FLUXO DE COMEÇO-FIM CONTINUADO.
COM VARIAÇÕES NO ESPAÇO E TEMPO, MASSA E ENERGIA CONFORME O MOVIMENTO E A INTENSIDADE DA ONDA, FREQUÊNCIA E ALCANCE.
NUM CONTINUUM ESPAÇO-TEMPO-ENERGIA-MOMENTUM-MASSA-INTERAÇÕES E TRANSFORMAÇÕES.
COM EFEITO SOBRE GRAVIDADE, ELETROMAGNETISMO, E CAMPOS FORTE E FRACO.
OU SEJA, SE TEM UMA RELAÇÃO ENTRE A QUÂNTICA DE CAMPOS E ONDAS, COM A RELATIVIDADE, E ONDE A RELATIVIDADE PASSA A SER ONDULATÓRIA. OBEDECENDO A CURVATURA ONDA PARTÍCULA DE GRACELI.

G + = GRAVIDADE E TENSOR CURVATURA-ONDA GRACELI. = RELAÇÃO DE CONTINUUM E UNICIDADE ENTRE ENERGIA, ONDAS, GEOMETRIA, E CAMPOS. = G +
G + = O SÍMBOLO G NO SISTEMA DE TENSOR E CURVATURA-ONDA GRACELI TANTO É A GRAVIDADE QUANTO O PRÓPRIO TENSOR CURVATURA-ONDA GRACELI, FORMANDO UMA RELAÇÃO E CONTÍNUUM ENTRE A QUÂNTICA [TEORIA DE ONDAS] E A RELATIVIDADE GERAL, E VARIAÇÕES DO ESPAÇO E TEMPO DENTRO DO SISTEMA DE TENSOR CURVATURA-ONDA GRACELI.
G +
Em mecânica quântica, nível de energia ou nível energético é um estado quântico (de um elétron, átomo ou molécula, por exemplo) cuja energia está bem definida ao longo do tempo. Desse modo, os níveis energéticos são as funções próprias do operador hamiltoniano, e suas energias respectivas são seus valores.[1]
As diferentes espectroscopias estudam as transições entre os diferentes níveis de energia. A espectroscopia infravermelha, por exemplo, estuda transições entre os níveis energéticos da vibração molecular, a espectroscopia ultravioleta e visível estuda as transições eletrônicas e a espectroscopia Mössbauer se ocupa das transições nucleares.[2]
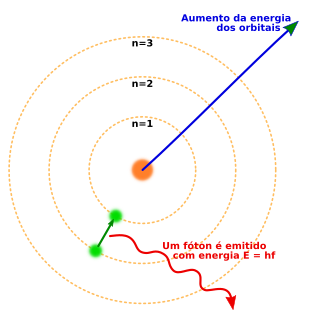
Na química e na física atômica, uma camada eletrônica, ou um nível de energia principal, pode ser pensado como uma órbita de elétrons girando ao redor do núcleo do átomo. A camada mais próxima do núcleo é chamada de "camada 1" (também chamada de "camada K"), seguida da" camada 2" (ou "camada L"), depois a "camada 3" (ou "camada M"), e assim por diante, conforme se afasta do núcleo. As camadas correspondem aos números quânticos principais (n = 1,2,3,4...) ou são nomeadas na ordem alfabética com letras usadas na rotação de raio-x (K, L, M,...).
Se a energia potencial é considerada zero a uma distância infinita do núcleo do átomo ou da molécula, convenção usual, então os respectivos estados eletrônicos possuem energia potencial negativa.
Se um átomo, íon ou molécula está no menor estado possível de energia, ele e seus elétrons são ditos no estado fundamental. Se ele está em um nível mais alto de energia, é dito excitado, ou quaisquer elétrons que possuem energia maior do que o estado fundamental estão excitados. Se mais de um estado mecânico quântico está com a mesma energia, os níveis de energia estão "degenerados". Eles são então chamados de níveis de energia degenerados.[3]
Explicação
Estados quantizados de energia resultam de uma relação entre a energia de uma partícula e o seu comprimento de onda. Para uma partícula confinada, como um elétron em um átomo, a função de onda tem a forma de ondas estacionárias. Apenas estados estacionários com energia correspondente a um número inteiro de comprimentos de onda podem existir; para outros estados as ondas interferem destrutivamente, resultando em probabilidade de densidade igual a zero. Exemplos elementares que mostram matematicamente como níveis de energia acontecem são a partícula em uma caixa e o oscilador harmônico quântico. O elétron é uma partícula subatômica fundamental que carrega uma carga elétrica negativa.[3]
História
Na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.[1]
Ernest Rutherford, no início do século XX, realiza o experimento conhecido como espalhamento de Rutherford ,[2] no qual ele incidiu um feixe de partículas alfa (α) sobre uma folha de ouro e observou que, ao contrário do que era esperado - que as partículas deveriam ser refletidas pelos átomos de ouro considerados maciços até então -, muitas partículas atravessaram a folha de ouro e outras sofreram desvios. A partir da análise dessa experiência, afirmou que átomos eram constituídos de uma nuvem difusa de elétrons carregados negativamente que circundavam um núcleo atômico denso, pequeno e carregado positivamente.[1]
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo planetário para o átomo, com elétrons orbitando ao redor do "núcleo-sol". Porém, a aberração mais séria desse modelo é a perda de energia dos elétrons através da radiação síncrotron: uma partícula carregada eletricamente ao ser acelerada emite radiações eletromagnéticas que têm energia; fosse assim, ao orbitar em torno do núcleo atômico, o elétron deveria gradativamente emitir radiações e cada vez mais aproximar-se do núcleo, em uma órbita espiralada, até finalmente chocar-se contra ele. Um cálculo rápido mostra que isso deveria ocorrer quase que instantaneamente.
Postulado de Bohr
Através das descrições quânticas da radiação eletromagnética propostas por Albert Einstein e Max Planck, o físico dinamarquês Niels Bohr desenvolve seu modelo atômico a partir de quatro postulados:[3]
- Os elétrons que circundam o núcleo atômico existem em órbitas que têm níveis de energia quantizados.
- A energia total do elétron (cinética e potencial) não pode apresentar um valor qualquer e sim, valores múltiplos de um quantum.[1]
- Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida (ou suprida) por um simples quantum de luz (também chamado de fóton), que tem energia exatamente igual à diferença de energia entre as órbitas em questão.
- As órbitas permitidas dependem de valores quantizados (bem definidos) de momento angular orbital, L, de acordo com a equação
G +
onde n = 1, 2, 3, ... é chamado de número quântico principal e h é a constante de Planck.[4]
A regra 4 afirma que o menor valor possível de n é 1. Isto corresponde ao menor raio atômico possível, de 0,0529 nm, valor também conhecido como raio de Bohr. Nenhum elétron pode aproximar-se mais do núcleo do que essa distância.
O modelo de átomo de Bohr é às vezes chamado de modelo semi-clássico do átomo, porque agrega algumas condições de quantização primitiva a um tratamento de mecânica clássica. Este modelo certamente não é uma descrição mecânica quântica completa do átomo. A regra 2 diz que as leis da mecânica clássica não valem durante um salto quântico, mas não explica que leis devem substituir a mecânica clássica nesta circunstância. A regra 4 diz que o momento angular é quantizado, mas não diz por quê.
Expressão para o raio de Bohr
Considere o caso de um íon com a carga do núcleo sendo Ze e um eléctron movendo-se com velocidade constante v ao longo de um círculo de raio r com centro no núcleo.[5]
A força de Coulomb sobre o electrão é
G +
A força de Coulomb é a força centrípeta. Logo:
G +
Usando a regra de quantização do momento angular de Bohr:
G +
Temos para o n-ésimo raio de Bohr:
G +
E a velocidade do electrão na n-ésima órbita:
G +
Equação de Rydberg
A equação de Rydberg, que era conhecida empiricamente antes da equação de Bohr, está agora na teoria de Bohr para descrever as energias de transições entre um nível de energia orbital e outro. A equação de Bohr dá o valor numérico da já conhecida e medida constante de Rydberg, e agora em termos de uma constante fundamental da natureza, inclui-se a carga do elétron e a constante de Planck.[1] Quando o elétron é movido do seu nível de energia original para um superior e, em seguida, recua um nível retornando à posição original, resulta num fóton a ser emitido. Usando a fórmula derivada para os diferentes níveis de energia de hidrogênio, determinam-se os comprimentos de onda da luz que um átomo de hidrogênio pode emitir. A energia de um fóton emitido por um átomo de hidrogênio é determinado pela diferença de dois níveis de energia de hidrogênio:[1]
G +
onde ni é o nível inicial , e nf é o nível final de energia. Uma vez que a energia de um fóton está
G +
o comprimento de onda do fóton emitido é dada pela
G +
Isto é conhecido como a equação de Rydberg, e o R da constante Rydberg é

G +
em unidades naturais . Esta equação foi conhecida no século XIX pelos cientistas que estudavam a espectroscopia, mas não havia nenhuma explicação teórica para estas equações ou uma previsão teórica para o valor de R, até Bohr. A propósito, a derivação de Bohr da constante Rydberg, bem como o acordo concomitante da equação de Bohr com as experimentalmente observadas linhas espectrais de Lyman (


Níveis energéticos dos elétrons em um átomo de hidrogênio
O modelo do átomo de Bohr explica bem o comportamento do átomo de hidrogênio e do átomo de hélio ionizado, mas é insuficiente para átomos com mais de um elétron.
Segue abaixo um desenvolvimento do modelo de Bohr que demonstra os níveis de energia no hidrogênio.
Sejam as seguintes convenções:
1. Todas as partículas são como ondas e, assim, o comprimento de onda do elétron, 
G +
onde h é a constante de Planck e me, a massa do elétron. Bohr não tinha levantado esta hipótese porque só depois é que foi proposto o conceito associado a esta afirmação (veja dualidade onda-partícula). Porém, permite chegar na próxima afirmação.
2. A circunferência da órbita do elétron deve ser um múltiplo inteiro de seu comprimento de onda:
G +
onde r é o raio da órbita do elétron e n, um número inteiro positivo.
3. O elétron mantém-se em órbita por forças eletrostáticas. Isto é, a força eletrostática é igual à força centrípeta:
G +
onde 
G +
Temos três equações e três incógnitas: v, 
G +
Pelo teorema do virial, a energia total simplifica-se para
G +
 |  |
 ---------------------------------------- G + |
Ou, depois de substituídos os valores das constantes:[7]
 ---------------------------------------- G + |
Assim, o menor nível de energia do hidrogênio (n = 1) é cerca de -13.6 eV. O próximo nível de energia (n = 2) é -3.4 eV. O terceiro (n = 3), -1.51 eV, e assim por diante. Note que estas energias são menores que zero, o que significa que o elétron está em um estado de ligação com o próton presente no núcleo. Estados de energia positiva correspondem ao átomo ionizado, no qual o elétron não está mais ligado, mas em um estado desagregado.
O modelo atômico de Bohr pode ser facilmente usado para a composição do modelo atômico de Linus Pauling. Apenas somando as camadas e as colocando na ordem de Pauling.
Frequência
A frequência orbital[5]

G +
Onde 
G +
A partir da Equação - acima - do movimento orbital mantido pela força de Coulomb acima temos
G +
Substituindo esta expressão na Equação (X) temos:

G +
Para o átomo
- 
G +
a qual está na região ultravioleta do espectro electromagnético.
Se o elétron irradia, a energia E irá decrescer tornando-se cada vez negativa e a partir da Equação do raio da órbita r também diminui. O decréscimo em r na Equação (Z), provoca um aumento na frequência f.
De modo que temos um efeito de pista que quando a energia é irradiada, E diminui, o raio orbital r diminui, a qual por sua vez causa um aumento da frequência orbital f e aumentando continuamente a frequência irradiada.
Este modelo planetário prevê que o electrão se mova em espiral para dentro em direção ao núcleo, emitindo um espectro contínuo. Calcula-se que este processo não dure mais do que 
A primeira evidência da quantização em átomos foi a observação de linhas espectrais na luz vinda do sol em cerca de 1 800 por Joseph von Fraunhofer e William Hyde Wollaston. A noção de níveis de energia foi proposta em 1913 pelo físico dinamarquês Niels Bohr na Teoria de Bohr para o átomo. A teoria da mecânica quântica moderna, dando a explicação desses níveis de energia em termos da equação de Schrödinger, foi desenvolvida por Erwin Schrödinger e Werner Heisenberg em 1926.[3]
Transição de Níveis de Energia
Elétrons em átomos e moléculas podem trocar (fazer transição) de níveis de energia ao emitirem ou absorverem um fóton, ou radiação eletromagnética, tal energia deve ser exatamente igual à diferença energética entre os dois níveis. Elétrons podem também ser completamente removidos de uma espécie química, como um átomo, molécula, ou íon. A remoção completa de um elétron de um átomo pode ser uma forma de ionização, que é efetivamente mover o elétron para um orbital com um número quântico principal infinito, tão longe de forma a praticamente não ter efeito algum sobre o átomo remanescente (íon). Para vários tipos de átomos, existem a 1ª, 2ª, 3ª energia de ionização e assim por diante, que podem ser fornecidas ao átomo em estado fundamental para remover elétrons do menor ao maior nível de energia. Energia em quantidades opostas também pode ser liberada, muitas vezes em forma de energia fotoelétrica, quando elétrons entram em contato com ións positivamente carregados (ou átomos). Moléculas também podem passar por transições em seus níveis de energia vibracionais e rotacionais. A transição de nível de energia também pode ser não-radioativa, significando que não ocorre a emissão ou absorção de um fóton.
Se um átomo, íon ou molécula está no menor nível de energia possível, ele e seus elétrons são ditos em estado fundamental. Se estão no maior nível de energia, são ditos excitados, ou qualquer elétron possui uma energia maior que o estado fundamental está excitado. Tal espécie pode ser excitada a um nível de energia maior ao absorver um fóton cuja energia é igual a diferença de energia entre dois níveis. Por outro lado, uma espécie pode ir para um nível de energia inferior ao emitir espontaneamente um fóton com energia igual a diferença energética. A energia de um fóton é igual à constante de Planck (h) vezes a sua frequência (f) e, portanto, é diretamente proporcional à sua frequência, ou inversamente proporcional ao seu comprimento de onda (λ).
G +
onde c, velocidade da luz, é igual a 
de 2018) |

G +
O princípio de Aufbau (do alemão Aufbau, que significa "construção") ou princípio da estruturação, também conhecido como diagrama de distribuição eletrônica ou diagrama de Linus Pauling, é usado para determinar a configuração eletrônica de um átomo, molécula ou íon. O princípio postula um processo hipotético em que um átomo é "construído" pela adição progressiva de elétrons. Os elétrons preenchem os orbitais atômicos disponíveis dos níveis de energia mais baixos antes de ocuparem níveis mais altos.[1] Como eles são adicionados, eles assumem as condições mais estáveis (orbital atômico) com relação ao núcleo e aos elétrons que já estão lá.[2] Por exemplo, a camada 1s é preenchida antes que a subcamada 2s esteja ocupada. Desta forma, os elétrons de um átomo ou íon formam a configuração eletrônica mais estável possível. Um exemplo é a configuração 1s2 2s2 2p6 3s2 3p3 para o átomo de fósforo, o que significa que a subcamada 1s tem 2 elétrons e assim por diante[1].
O princípio de Aufbau é um diagrama fundamental para o entendimento da estrutura da Tabela Periódica dos Elementos, o qual no Brasil, em muitos livros de química, o modelo é atribuído ao Químico norte-americano Linus Pauling; entretanto, não há evidências de que tenha sido ele o criador desse método. Especificamente, o diagrama é um auxílio mnemônico para descrever a ordem correta com que os elétrons de um átomo preenchem os subníveis da eletrosfera. Ele está baseado na chamada Regra de Madelung, atribuída ao físico alemão Erwin Madelung. Segundo esta regra empírica, os subníveis devem ser preenchidos na ordem crescente de 








A atribuição do diagrama a Linus Pauling é largamente difundida no Brasil, inclusive em livros-texto e em programas para diferentes tipos de concursos públicos e particulares, especialmente na área do ensino médio e vestibulares. Porém, esse nome do diagrama carece completamente de citações internacionais[3]. Uma forma muito mais visualmente complexa do diagrama de fato aparece no célebre livro-texto de química de Pauling, General Chemistry: An Introduction to Descriptive Chemistry and Modern Chemical Theory (1947)[4]. Porém, a versão moderna do diagrama parece ter sido primeiramente apresentada pelo cientista chinês Pao-Fang Yi[5][6] e aperfeiçoada na Austrália pelo professor L. M. Simmons[7]. O professor Therald Moeller[8] em seu livro de Química Inorgânica, descreveu e detalhou a forma do diagrama que conhecemos atualmente. A atribuição a Pauling parece ser assim um caso do chamado Efeito Matthew[9].
Uma justificativa teórica para a validade destas regras, baseada no modelo de Thomas-Fermi, foi apresentada em 1962 pelo químico soviético V. Klechkovsky[10], o qual tem por isso seu nome associado ao diagrama, especialmente em países de língua russa e francesa[11]
Diagrama
Distribuição eletrônica
| camada | subnível | |
|---|---|---|
| 1 |  |  |
| 2 |  |  e e  |
| 3 |  |  , ,  e e  |
| 4 |  |  , ,  , ,  e e  |
| 5 |  |  , ,  , ,  e e  |
| 6 |  |  , ,  e e  |
| 7 |  |  e e  |
| Nota | ||
 (sharp = nítido), (sharp = nítido),  (principal), (principal),  (diffuse = difuso), (diffuse = difuso),  (fundamental) (fundamental) | ||
G +
Número máximo de elétrons em cada subnível

| subnível | Número de elétrons por subnível |
|---|---|
 |  elétrons elétrons |
 |  elétrons elétrons |
 |  elétrons elétrons |
 |  elétrons elétrons |
G +
O diagrama é representado assim:
| camada | subnível |
|---|---|
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
| Nota | |
 (sharp = nítido), (sharp = nítido),  (principal), (principal), (diffuse = difuso), (diffuse = difuso),  (fundamental) (fundamental) | |
G +
A ordem do diagrama que se lê é: 
G +
Na química, valência é um número que indica a capacidade que um átomo de um elemento tem de se combinar com outros átomos, capacidade essa que é medida pelo número de elétrons que um átomo pode dar, receber, ou compartilhar de forma a constituir uma ligação química. Isto está relacionado com o número de espaços omissos nas camadas eletrônicas do átomo. Os adjetivos que descrevem as valências atômicas usam prefixos gregos, como mono, bi, tri e tetra para as valências respectivamente iguais a 1, 2, 3, 4. Grupo dos elementos principais que são os metais geralmente possuem apenas uma valência, igual ao número de elétrons na camada de valência. Metais de transição freqüentemente possuem diversas valências (veja lista abaixo).[1][2]
O termo valência não significa o mesmo que o termo número de oxidação. Para um símples composto iônico o número de oxidação de um metal será geralmente igual ao de valência, embora para compostos covalentes que envolvem não-metais haja frequentemente uma diferença.[3]
Lista
Lista de distribuição eletrônica comuns para os primeiros 103 elementos em ordem de número atômico:
G +
Lista dos números de oxidação
Esta é uma lista de todos os números de oxidação conhecidos de todos os elementos químicos. Os estados de oxidação mais comuns estão em negrito. O número de oxidação 0, que existe para todos os elementos, corresponde à coluna com o símbolo do elemento.[1]
| −1 | H | +1 | |||||||||||
| He | |||||||||||||
| −1 | Li | +1 | |||||||||||
| Be | +2 | ||||||||||||
| B | +1 | +2 | +3 | ||||||||||
| −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | O | +1 | +2 | |||||||||
| −1 | F | ||||||||||||
| Ne | |||||||||||||
| −1 | Na | +1 | |||||||||||
| Mg | +1 | +2 | |||||||||||
| Al | +1 | +3 | |||||||||||
| −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| Ar | |||||||||||||
| K | +1 | ||||||||||||
| Ca | +2 | ||||||||||||
| Sc | +1 | +2 | +3 | ||||||||||
| −1 | Ti | +2 | +3 | +4 | |||||||||
| −1 | V | +1 | +2 | +3 | +4 | +5 | |||||||
| −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | Co | +1 | +2 | +3 | +4 | +5 | |||||||
| −1 | Ni | +1 | +2 | +3 | +4 | ||||||||
| Cu | +1 | +2 | +3 | +4 | |||||||||
| Zn | +2 | ||||||||||||
| Ga | +1 | +2 | +3 | ||||||||||
| −4 | Ge | +1 | +2 | +3 | +4 | ||||||||
| −3 | As | +2 | +3 | +5 | |||||||||
| −2 | Se | +2 | +4 | +6 | |||||||||
| −1 | Br | +1 | +3 | +4 | +5 | +7 | |||||||
| Kr | +2 | ||||||||||||
| Rb | +1 | ||||||||||||
| Sr | +2 | ||||||||||||
| Y | +1 | +2 | +3 | ||||||||||
| Zr | +1 | +2 | +3 | +4 | |||||||||
| −1 | Nb | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Pd | +2 | +4 | |||||||||||
| Ag | +1 | +2 | +3 | ||||||||||
| Cd | +2 | ||||||||||||
| In | +1 | +2 | +3 | ||||||||||
| −4 | Sn | +2 | +4 | ||||||||||
| −3 | Sb | +3 | +5 | ||||||||||
| −2 | Te | +2 | +4 | +5 | +6 | ||||||||
| −1 | I | +1 | +3 | +5 | +7 | ||||||||
| Xe | +2 | +4 | +6 | +8 | |||||||||
| Cs | +1 | ||||||||||||
| Ba | +2 | ||||||||||||
| La | +2 | +3 | |||||||||||
| Ce | +2 | +3 | +4 | ||||||||||
| Pr | +2 | +3 | +4 | ||||||||||
| Nd | +2 | +3 | |||||||||||
| Pm | +3 | ||||||||||||
| Sm | +2 | +3 | |||||||||||
| Eu | +2 | +3 | |||||||||||
| Gd | +1 | +2 | +3 | ||||||||||
| Tb | +1 | +3 | +4 | ||||||||||
| Dy | +2 | +3 | |||||||||||
| Ho | +3 | ||||||||||||
| Er | +3 | ||||||||||||
| Tm | +2 | +3 | |||||||||||
| Yb | +2 | +3 | |||||||||||
| Lu | +3 | ||||||||||||
| Hf | +2 | +3 | +4 | ||||||||||
| −1 | Ta | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Pt | +2 | +4 | +5 | +6 | |||||||||
| −1 | Au | +1 | +2 | +3 | +5 | ||||||||
| Hg | +1 | +2 | +4 | ||||||||||
| Tl | +1 | +3 | |||||||||||
| −4 | Pb | +2 | +4 | ||||||||||
| −3 | Bi | +3 | +5 | ||||||||||
| −2 | Po | +2 | +4 | +6 | |||||||||
| −1 | At | +1 | +3 | +5 | +7 | ||||||||
| Rn | +2 | ||||||||||||
| Fr | +1 | ||||||||||||
| Ra | +2 | ||||||||||||
| Ac | +3 | ||||||||||||
| Th | +2 | +3 | +4 | ||||||||||
| Pa | +3 | +4 | +5 | ||||||||||
| U | +3 | +4 | +5 | +6 | |||||||||
| Np | +3 | +4 | +5 | +6 | +7 | ||||||||
| Pu | +3 | +4 | +5 | +6 | +7 | ||||||||
| Am | +2 | +3 | +4 | +5 | +6 | ||||||||
| Cm | +3 | +4 | |||||||||||
| Bk | +3 | +4 | |||||||||||
| Cf | +2 | +3 | +4 | ||||||||||
| Es | +2 | +3 | |||||||||||
| Fm | +2 | +3 | |||||||||||
| Md | +2 | +3 | |||||||||||
| No | +2 | +3 | |||||||||||
| Lr | +3 | ||||||||||||
| Rf | +4 |
G +
Um desenho com um formato parecido foi usado por Irving Langmuir em 1919 num dos seus estudos sobre a regra do octeto. A periodicidade dos números de oxidação foi uma das particularidades que levaram Langmuir a adotar a regra.[2]
G +
G +
- Gerar link
- X
- Outros aplicativos






















Comentários
Postar um comentário